「医学系指針」の対象となる試験の手順
- TOP
- 研究者・医療関係者の皆さん向け
- 手引き
- 研究者
- 「医学系指針」の対象となる試験の手順
「医学系指針」の対象となる試験の手順
(2019年12月2日発行の共通メモランダム参照)
施設で報告義務のある有害事象が発生した場合は、手順に従って、施設研究責任者から当該試験の研究事務局に報告を行ってください。詳細等は、プロトコール「10.有害事象の報告」または「有害事象報告に関する共通ガイドライン(JCTN-有害事象報告ガイドライン)」「JCOG臨床安全性情報取扱いガイドライン v3.1」をご覧ください。
また、 旧運用(JCOG臨床安全性情報取扱いガイドライン v2.0) で有害事象報告を行う試験一覧に該当する試験は「旧運用(JCOG臨床安全性情報取扱いガイドライン v2.0)の有害事象報告」ページの手順に従ってください。
報告ルートと結果通知ルート
施設研究責任者は、施設で緊急報告の対象となる有害事象が認められた場合、期限内に研究事務局へ規定の書式を用いて報告してください。
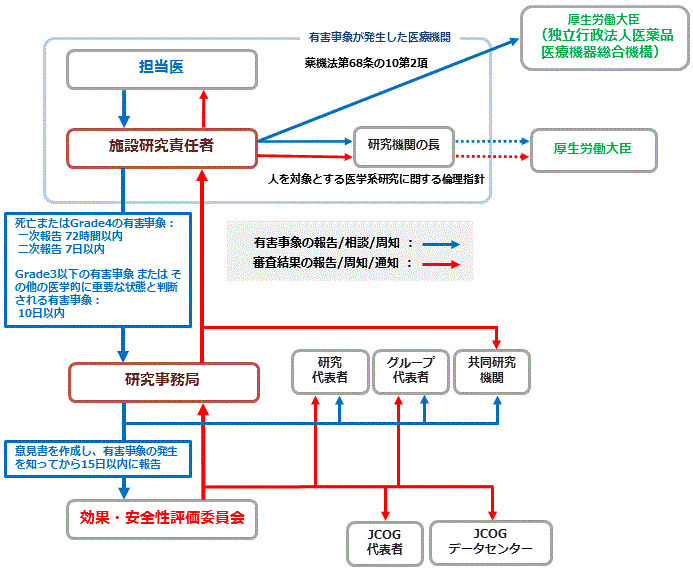
緊急報告の対象となる有害事象と報告期限・書式
◆緊急報告の対象となる有害事象
- 死亡
- Grade 4の有害事象
- 予期されないGrade 3/2/1の有害事象 かつ 有害事象の治療のために24時間以上の入院または入院期間の延長※が必要となるもの
※「入院または入院期間の延長」については、有害事象の治療のために24時間以上の入院/入院期間の延長が医学的に必要となるもののみを指し、次のような場合は報告対象外とする。
・有害事象が消失または軽快しているものの経過観察のために行われた入院/入院期間の延長
・遠隔地から受診する場合等、患者の負担を軽減する目的の入院/入院期間の延長
・その他、医学的には必要のない入院/入院期間の延長 - その他の医学的に重要な状態と判断される有害事象
※ただし、以下のいずれかに該当する場合は緊急報告の対象外とする
- 最終プロトコール治療日から31日以降に発生した有害事象(死亡を含む)のうち、治療との因果関係が否定できる(unlikely, not relatedのいずれか)もの
- 骨髄異形成症候群(MDS:Myelodysplastic syndromes)、二次がん
- 研究計画書で緊急報告対象外と定められた有害事象(各研究計画書を参照)
◆緊急報告の報告期限
| Grade 1/2/3 | Grade 4 | 死亡 | その他医学的に重要な状態 | ||||||
| 予期される | 予期されない | 予期される | 予期されない | 予期される | 予期されない | ||||
| 入院 なし |
入院 あり |
入院 なし |
入院 あり |
||||||
| 因果関係あり | 報告不要 | 報告不要 | 報告不要 | 初回:10日以内 追加:随時 |
一次報告:72時間以内 二次報告:7日以内 追加報告:随時 |
初回:10日以内 追加:随時 |
|||
| 因果関係なし | 報告不要 | 報告不要 | 報告不要 | <治療中または最終プロトコール治療日から30日以内のみ> 初回:10日以内 追加:随時 |
<治療中または 最終プロトコール治療日から30日以内のみ> 一次報告:72時間以内 二次報告:7日以内 追加報告:随時 |
<治療中または最終プロトコール治療日から30日以内のみ> 初回:10日以内追加:随時 |
|||
※ 報告を要するものはすべて、研究機関の長に対する報告も必要である。さらに、報告対象のうち予期されない、かつ、因果関係が否定できない場合は、厚生労働大臣に対する報告も必要である。
報告書の記入方法
JCOG報告書記載の手引きを参考に報告書を作成してください。
ダウンロード書式
この項目に関するFAQはこちら
その他の手引き
